A Agência Nacional de Vigilância Sanitária (Anvisa) publicou dois editais de processos seletivos para formação de cadastro reserva de estagiários. As vagas são para estudantes de nível médio, nível superior e pós-graduação em diversas áreas, com recebimento de bolsa-estágio.
Conforme estabelecido na legislação, o processo seletivo reserva 10% das vagas de estágio de cada perfil às pessoas com deficiência (art. 17, § 5º, da Lei 11.788/2008). Também assegura a reserva de 30% das vagas oferecidas para cada curso aos candidatos negros (pretos ou pardos – Decreto 9.427/2018).
As inscrições são gratuitas e podem ser feitas até as 12h do dia 15 de fevereiro de 2024. Saiba mais abaixo.
Vagas
O Edital n. 01/2024 estabelece que o candidato à vaga de estagiário deverá estar regularmente matriculado e frequente em um dos seguintes cursos:
- Nível médio: nível médio.
- Nível superior graduação: Administração; Agronomia; Arquitetura; Arquivologia; Biomedicina; Bioquímica; Biotecnologia; Ciências de Dados; Ciências Biológicas; Ciências Contábeis; Ciências Políticas; Comunicação Social; Design; Direito; Economia; Enfermagem; Engenharia Ambiental; Engenharia Biomédica; Engenharia Civil; Engenharia de Produção; Engenharia de Alimentos; Engenharia Elétrica; Engenharia Mecânica; Engenharia Química; Estatística; Farmácia; Fotografia; Gestão da Informação; Gestão De Políticas Públicas; Gestão de Serviços de Saúde; Gestão Pública; Informática; Jornalismo; Marketing; Medicina; Medicina Veterinária; Nutrição; Odontologia; Pedagogia; Psicologia; Publicidade; Química; Recursos Humanos; Relações Internacionais; Saúde Coletiva e Terapia Ocupacional.
Para a área de Informática, serão aceitos outros cursos relacionados, como: Análise de Sistemas, Análise e Desenvolvimento de Sistemas, Ciência da Computação, Engenharia da Computação, Engenharia de Redes de Computadores, Engenharia de Telecomunicações, Gestão da Tecnologia da Informação, Sistemas de Informação, Sistemas de Internet e Tecnologia em Sistema de Informação.
Já o Edital n. 02/2024 determina que o candidato à vaga de estagiário deverá estar regularmente matriculado e frequente em um dos seguintes cursos:
- Nível superior pós-graduação: Administração; Agronomia; Bioestatística; Biomedicina; Ciências Biológicas; Ciências de Dados e Tecnologia da Informação; Comunicação Social; Design; Direito; Economia; Enfermagem; Engenharia Civil; Engenharia de Produção; Engenharia de Alimentos; Engenharia de Materiais; Engenharia Elétrica; Epidemiologia; Estatística; Farmácia; Gestão de Serviços de Saúde e Saúde Coletiva; Gestão Pública; Medicina; Nutrição e Química.
Os editais apresentam os requisitos exigidos e outras competências desejáveis.
Carga horária semanal
O regime do estágio será de 20 horas semanais para os estudantes de nível médio e de 30 horas semanais para os estudantes de nível superior (graduação e pós-graduação), a serem cumpridas em horários e turnos definidos pela Anvisa.
Valor da bolsa-estágio
– Nível médio: R$ 486,05.
– Nível superior (graduação): R$ 1.125,69.
– Nível superior (pós-graduação): R$ 1.665,22.
Os valores estão estabelecidos na Instrução Normativa n. 213/2019, publicada pelo então Ministério da Economia. O estagiário tem direito também a auxílio-transporte, no valor de R$ 10,00 por dia estagiado.
Inscrições
As inscrições já estão abertas, exclusivamente pela internet, e podem ser feitas no site do Centro de Integração Empresa Escola (CIEE), até as 12h do dia 15 de fevereiro de 2024, pelos links abaixo:
– Nível médio e superior (graduação)
A seleção dos candidatos será composta por análise curricular e entrevista, ambas de caráter eliminatório e classificatório. Após a avaliação dos currículos, a lista de classificação dos aprovados será divulgada no site do CIEE.
O processo seletivo terá validade de 12 meses a partir da publicação da lista final de classificados, podendo, a critério da Anvisa, ser renovado por igual período.








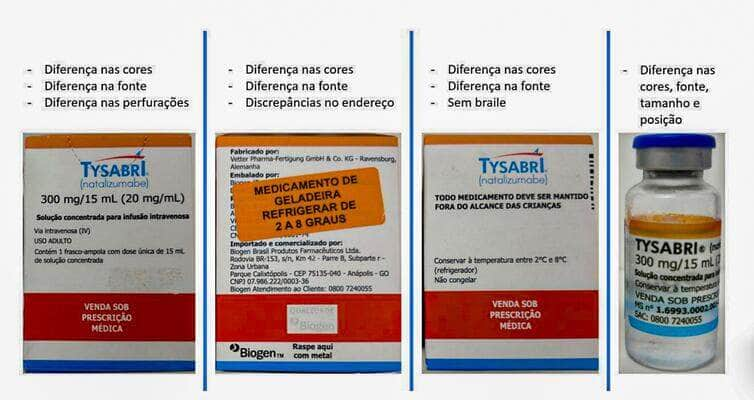 Brasília (DF) 03/11/2023 – Anvisa alerta sobre falsificação dos medicamentos Tysabri® e Ozempic ® Foto: Avisa/DivulgaçãoErros de ortografia e diferença de cores e de fonte evidenciam falsificação do Tysabri – Avisa/Divulgação
Brasília (DF) 03/11/2023 – Anvisa alerta sobre falsificação dos medicamentos Tysabri® e Ozempic ® Foto: Avisa/DivulgaçãoErros de ortografia e diferença de cores e de fonte evidenciam falsificação do Tysabri – Avisa/Divulgação